Anemie is de medische term voor bloedarmoede. Bloed bestaat uit cellen en een vloeistof, plasma (zie Algemeen: bloed, beenmerg en lymfklieren). Het leeuwendeel van bloed wordt gevormd door de rode cellen, de erytrocyten. Erytrocyten zijn de cellen die een belangrijke rol spelen bij het zuurstoftransport. Ze bevatten een eiwit, hemoglobine, afgekort Hb, dat is opgebouwd uit vier verschillende ketens, gerangschikt om een ijzermolecuul (dia 2). Ze ontstaan in het beenmerg uit voorlopercellen, de erytroblasten (dia 3). Voor de aanmaak zijn bouwstoffen zoals ijzer en de vitamines foliumzuur en B12 nodig. Daarnaast speelt een bloedhormoon, erytropoietine, afgekort Epo, een belangrijke rol. Eenmaal vanuit het beenmerg afgeleverd aan het bloed zullen de rode bloedcellen 100 tot 120 dagen in het bloed circuleren. Rode bloedcellen leven dus niet oneindig lang. Verouderde rode bloedcellen worden voornamelijk door de milt, de lever en het beenmerg verwijderd.

Dia 1
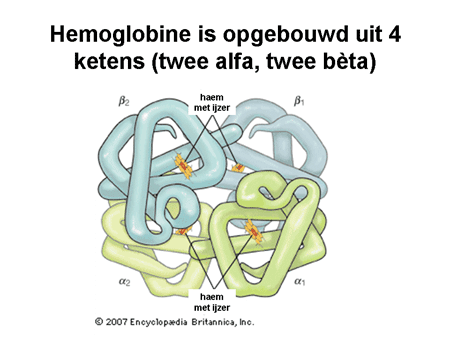
Dia 2. Hemogloblinemolecuul
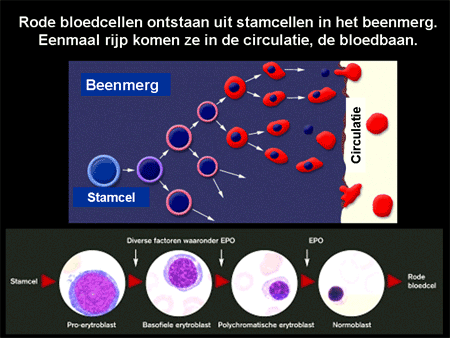
Dia 3
Inleiding: symptomen en oorzaken
De symptomen van bloedarmoede zijn vaag en algemeen. Door het tekort aan rode cellen zullen patiënten bleek zien, met bleekheid van de huid en de slijmvliezen (ogen, binnenzijde van de mond). Mensen kunnen moe zijn en duizeligheid (zwart worden voor de ogen) ervaren bij snel opstaan. Omdat er minder mogelijkheid van zuurstoftransport is, ontstaat er kortademigheid bij inspanning en als compensatie voor de verminderde hoeveelheid bloed een snellere hartwerking met hartkloppingen en een snellere hartslag in rust. De klachten nemen in ernst toe naarmate de symptomen sneller ontstaan. Wanneer daarentegen de bloedarmoede zich heel geleidelijk (gedurende vele maanden) ontwikkeld heeft, past het lichaam zich aan en kunnen patiënten verrassend weinig klachten hebben.
Bloedarmoede kan vele oorzaken hebben. Om de oorzaak ervan op te sporen is het praktisch om gebruik te maken van een simpele indeling. Daarbij wordt de systematiek van aanmaak, verlies en afbraak van rode bloedcellen gehanteerd. Een tekort kan worden veroorzaakt door een stoornis in de aanmaak (tekort aan bouwstoffen of afwijkingen in het beenmerg), door een plotseling of langzaam ontstaand verlies van bloed, of door een verhoogde afbraak van rode bloedcellen in het lichaam, hemolyse genaamd.

Dia 4

Dia 5
Wanneer een nieuwe patiënt met bloedarmoede bij de arts komt, zal de arts ook deze systematische benadering afwerken, waarbij natuurlijk bij die patiënt eerst wordt gekeken naar de meest logische oorzaken. Om wat voor patiënt het gaat kan dan sturend zijn. Als het gaat om een patiënt met maag- of darmklachten, ligt het voor de hand te denken aan bloedverlies uit de darm. Een patiënt die slecht heeft gegeten, zou een vitamine- en/of ijzergebrek kunnen hebben. Sommige erfelijke vormen van bloedarmoede met verhoogde afbraak komen vooral in Afrikaanse en Aziatische landen voor. Vaak kan een huisarts met een goede serie vragen, lichamelijk onderzoek en betrekkelijk simpel bloedonderzoek de oorzaak opsporen. Lukt dit niet, dan wordt de hulp ingeroepen van de internist of hematoloog, of – in het geval van kinderen – de kinderarts.
Hier worden kort de meest voorkomende oorzaken van bloedarmoede besproken. Omdat dit een Nederlandstalige website is, wordt vooral aandacht besteed aan de oorzaken van bloedarmoede in de westerse wereld.
Verschillende soorten anemie
Anemie door gestoorde aanmaak
Rode bloedcellen worden in het beenmerg aangemaakt. Als er sprake is van een beenmergziekte, komt de aanmaak in het gedrang. Dit geldt ook als er een tekort is aan bouwstoffen (zie Anemie door tekort aan voedingsmiddelen of erytropoietine).
Beenmerg zit in de botten. Als het beenmerg in beslag wordt genomen door andere cellen (bij bloed- en beenmergziekten zoals leukemie of multipel myeloom [ziekte van Kahler], of bij uitzaaiingen van kanker in het beenmerg), blijft er onvoldoende ruimte over voor de aanmaak van rode cellen. Bijna altijd is er dan ook een tekort aan andere bloedcellen, zoals de leukocyten (witte bloedcellen) en trombocyten (bloedplaatjes). Er is dan een beenmergonderzoek nodig om de oorzaak van het niet goed functioneren van de bloedaanmaak op te sporen.
Er zijn een paar aparte oorzaken van anemie die ook kunnen worden gerekend tot de categorie ‘anemie door gestoorde aanmaak’:
Anemie door chronische ziekte
Aplastische anemie
Pure red cell aplasia (PRCA)
PRCA staat voor: selectieve (‘pure’) aanmaakstoornis (‘aplasia’) van rode cellen (‘red cell’). Er is een aangeboren vorm die meestal gedurende het eerste levensjaar manifest wordt, Diamond Blackfan-anemie geheten, en een later tijdens het leven verworven vorm. Het zijn zeer zeldzame aandoeningen waarbij selectief alleen de aanmaak van rode cellen ontbreekt. Een patiënt heeft daarbij een volledig normaal beenmerg wat de andere cellijnen betreft.
We gaan hier alleen in op de later tijdens het leven verworven vorm. De oorzaak van dit ziektebeeld is meestal niet bekend. Over het algemeen wordt aangenomen dat het een ontspoorde afweerstoornis is, waarbij het lichaam zelf de voorlopercellen van de erytrocyten aanvalt. Dit komt soms voor bij kwaadaardige bloedziekten die juist de cellen aantasten die instaan voor de afweer, de lymfocyten, zoals CLL (chronische lymfatische leukemie) of bepaalde typen non-Hodgkin-lymfoom. Omdat de ziekte in zeldzame gevallen samengaat met een gezwel in de borstkas (een zogenaamd thymoom), zal er vaak een CT-scan van de borst gemaakt worden om dit uit te sluiten. Een enkele keer kunnen virussen, vooral het Parvo B19-virus – een virus dat zich kan binden aan de rode voorlopercellen en deze daardoor tijdelijk beschadigt – aangetroffen worden. Vooral patiënten met een erfelijke hemolytische anemie (een ziekte met verhoogde afbraak, en dus ook verhoogde aanmaak van rode cellen) zijn hier gevoelig voor. Het Parvo B19-virus veroorzaakt bij kinderen de ‘vijfde ziekte’.
De therapie van pure red cell aplasia is meestal gericht op het onder controle brengen van de onderliggende oorzaak en/of het uitschakelen van de ontspoorde afweerreactie. Prednison, azathioprine (Imuran) en middelen zoals ciclosporine (Neoral) zijn de meest gebruikte.
Anemie door tekort aan voedingsmiddelen of erytropoietine
Voor de aanmaak van rode bloedcellen zijn er drie belangrijke bouwstoffen: ijzer, foliumzuur en vitamine B12.
IJzergebreksanemie
Wereldwijd is dit de meest voorkomende vorm van bloedarmoede, die grotendeels wordt veroorzaakt door langdurig bloedverlies. Een normale volwassene heeft circa 3000 tot 5000 mg ijzer in voorraad, waarvan de grote meerderheid aanwezig is in de rode bloedcellen, de rest is opgeslagen in de lever. Bij chronisch verlies van bloed (langdurige hevige menstruatie, een maagzweer of darmontsteking) zal het niet lukken om via de voeding voldoende ijzer ter compensatie binnen te krijgen en zal er uiteindelijk een tekort aan ijzer ontstaan. Begrijpelijkerwijze kan dit mechanisme soms in versnelde en verhevigde mate optreden na een forse bloeding. Daardoor worden de rode cellen minder goed aangemaakt, ze worden kleiner en bleek. Andere oorzaken van een ijzertekort kunnen slechte voeding of een streng vegetarisch dieet zijn, of een maag- of darmafwijking waarbij het ijzer niet goed uit de voeding via de darm wordt opgenomen, een zogenaamde resorptiestoornis. Van dit laatste is de ziekte coeliakie (vlokatrofie) een goed voorbeeld.
Iemand die een normaal voedingspatroon heeft, zal geen tekort aan ijzer of vitaminen kunnen krijgen, tenzij het gaat om situaties met een sterk verhoogde behoefte aan ijzer zoals tijdens zwangerschap en borstvoeding, of herstel van de bloedaanmaak na een voorafgaande episode van tekort. Als er toch sprake is van een ijzergebreksanemie, is het zaak te zoeken naar de oorzaak van bloedverlies. Alleen maar ijzertherapie geven is dus niet voldoende: ijzergebrek bij een normale voeding is een signaal dat er iets mis is!
IJzergebrek kan meestal heel eenvoudig worden behandeld met ijzertabletten. Bij voorkeur worden deze voor de maaltijd ingenomen, omdat ze dan beter opgenomen worden. Bij veel klachten van de maag zijn er alternatieve ijzerpreparaten voorradig. Belangrijk is dat de behandeling met ijzer doorgezet wordt tot het bloedgehalte normaal is geworden, en dan nog drie tot zes maanden extra om de lichaamsvoorraden weer aan te maken. Er mag dus niet te vroeg gestopt worden met ijzertherapie.
Het heeft geen zin (en is zelfs fout) om ijzer te geven aan patiënten waarbij de anemie ontstaat door een andere oorzaak dan ijzertekort.
Tekort aan foliumzuur
Tekort aan vitamine B12: pernicieuze anemie
Er is in het lichaam een grote voorraad van de vitamine B12 aanwezig. Een tekort door slechte voeding treedt dan ook zelden op, behalve bij mensen met een extreme dieet, zoals veganisten. Een vaker voorkomende oorzaak van B12-tekort heeft te maken met een stoornis in de opname vanuit de voeding. Vitamine B12 wordt vanuit de voeding gebonden aan een eiwit, intrinsic factor genaamd, dat gemaakt wordt in de maagwand door de maagzuurvormende cellen. De intrinsic factor is nodig voor de vitamine B12 om vervolgens via de darmen te worden opgenomen. Als de maag ontbreekt, of als sprake is van het ontbreken van de maagzuurvormende cellen door een maagontsteking, kan er een tekort aan intrinsic factor ontstaan, waardoor ook bij goede voeding de vitamine B12 toch niet wordt opgenomen.
Een vaak voorkomende oorzaak van een tekort aan intrinsic factor is de ziekte pernicieuze anemie. ‘Pernicieus’ betekent ‘verderfelijk’, wat aangeeft hoe ernstig de situatie was toen men de oorzaak nog niet kende en de ziekte dus niet kon behandelen. Bij deze ziekte maakt het lichaam antistoffen (auto-antistoffen; auto = zelf) tegen de cellen die intrinsic factor maken. Deze cellen gaan daardoor dood, waardoor ze geen intrinsic factor meer kunnen maken. Via bloedonderzoek kan de aanwezigheid van deze antistoffen aangetoond worden. Als er sprake is van pernicieuze anemie, helpt het niet om vitamine B12 in tabletvorm aan te bieden, omdat het immers niet opgenomen kan worden. In dat geval wordt vitamine B12 per injectie gegeven. Na een aantal injecties kort op elkaar is het meestal voldoende om één keer per één tot drie maanden een injectie te krijgen. Deze behandeling moet levenslang worden volgehouden. Herkenning van de juiste oorzaak van de anemie is verder belangrijk omdat een tekort aan vitamine B12, mits niet of slecht behandeld, ook kan leiden tot ernstige neurologische stoornissen.
Zeldzame andere oorzaken van een tekort aan vitamine B12 zijn gelegen in afwijkingen in de darm. Als grote delen van de darm verwijderd zijn, met name het laatste stuk van de dunne darm, kan het vitamine B12 intrinsic factor-complex niet goed opgenomen worden. Vaak zullen dit type patiënten uit voorzorg al met vitamine B12-injecties behandeld worden.
Tekort aan erytropoietine (Epo)
Anemie door een tekort aan erytropoietine ofwel Epo komt vooral voor bij patiënten met een nieraandoening. Erytropoietine wordt aangemaakt door de nieren. Als deze niet werken in het geval van chronische nierziekten, moet de productie aangevuld worden. De meeste patiënten met een ernstige nierziekte zullen dan ook Epo-injecties krijgen.Erytropoietine wordt ook wel voorgeschreven bij beenmergziekten, vooral bij myelodysplastisch syndroom (MDS), en soms bij chemotherapie bij kankerbehandeling. Het effect valt meestal tegen, met name bij patiënten met ernstige bloedarmoede, omdat deze patiënten compensatoir zelf al heel veel Epo aanmaken. Los van de hoge kosten van Epo (in vergelijking met zo nu en dan een bloedtransfusie), is er ook enige twijfel of het geven van Epo altijd veilig is. Een te hoog bloedgehalte heeft immers ook risico’s, zoals helaas ook bij de doping met Epo in de wielercompetities is gebleken.
Anemie door bloedverlies
Dit is de meest voor de hand liggende oorzaak van bloedarmoede. In acute situaties bij verwondingen of grote operaties is het eigenlijk ook nooit een probleem om de oorzaak te vinden, omdat die zo zichtbaar is. In het geval van chronisch sluipend bloedverlies, bijna altijd vanuit de maag of darmen, kan echter het nodige speurwerk nodig zijn om de bloedingsplek te vinden.
Anemie door verhoogde afbraak: hemolytische anemie
In het geval van hemolyse (heem = bloed, lysis = uiteenvallen) worden de rode bloedcellen versneld afgebroken. Ze leven dan niet de gebruikelijke 100 tot 120 dagen, maar kunnen na enkele dagen, soms al enkele uren, weer afgebroken worden. Deze afbraak kan in de milt plaatsvinden, maar soms ook direct in de bloedbaan zelf. In dat laatste geval zullen fragmenten van de afgebroken rode bloedcellen, met name van hemoglobine, via de nieren het lichaam verlaten. Wanneer in korte tijd veel bloed wordt afgebroken, zal de urine donker gekleurd zijn.
Hemolyse kan in het laboratorium via bloedonderzoek meestal goed aangetoond worden. Door de verhoogde afbraak zal er een compensatoire toename van de aanmaak zijn, die zich uit in een toename van jonge erytrocyten, reticulocyten geheten. Uit de afgebroken erytrocyten komen verschillende stoffen vrij, onder meer het enzym LDH, dat bij hemolyse dan ook altijd verhoogd zal zijn. Daarnaast zal het eiwit hemoglobine, een van de bouwstenen in de rode bloedcel, vrijkomen en zich binden aan een ander eiwit: haptoglobine. Daardoor zal de hoeveelheid vrij haptoglobine sterk verlaagd zijn. Het uiteindelijk afgebroken hemoglobine komt in de galwegen terecht en zal een verhoging van de geelbruine galkleurstoffen geven, het bilirubine. Patiënten met hemolyse kunnen daarom geel zien, wat vaak het best te zien is aan het oogwit.
Er zijn veel oorzaken van hemolyse. De erfelijke vormen van hemolyse komen in de wereld verreweg het meest voor, maar worden in Nederland minder vaak aangetroffen. We bespreken in het kort de meest frequent aangetroffen vormen van hemolyse.
Erfelijke hemolytische anemie
De rode bloedcel kan beschouwd worden als een soort voorraadkamer die ervoor moet zorgen dat het hemogloblinemolecuul, verantwoordelijk voor zuurstoftransport, daar binnen in goed kan functioneren. Voor dit alles moet aan een aantal voorwaarden zijn voldaan. Om te beginnen moet de buitenkant van de cel (de membraan) buigzaam en solide zijn, om daarmee weerstand te kunnen bieden tegen de waterige omgeving waarin de cel rondzwemt. Verder zijn enzymen (bepaalde typen eiwitten) nodig die ervoor moeten zorgen dat de moleculen goed werken en goed energie genereren. Ten slotte moeten de vier ketens waaruit het hemogloblinemolecuul bestaat, goed aangemaakt worden (dia 2).
Op alle niveaus kunnen fouten aanwezig zijn, die meestal aangeboren zijn en dus ook weer kunnen worden doorgegeven aan het nageslacht. Daarom worden ze gerekend tot de erfelijke hemolytische anemieën. De mate van erfelijkheid is verschillend. Voor sommige vormen moet een kind de ‘aanleg’ van beide ouders erven om de ziekte in volle ernst te krijgen; als het de afwijking alleen van hetzij de vader hetzij de moeder heeft gekregen, zal er slechts een lichte vorm zonder klinische betekenis optreden, maar zal dat kind ‘drager’ zijn, dat wil zeggen dat het de ziekte weer kan overdragen op zijn eigen nakomelingen. Er zijn ook vormen die – net als de ziekte hemofilie – alleen bij mannen voorkomen en via de moeder worden doorgegeven. Het gaat hier om geslachtsgebonden afwijkingen die te maken hebben met het X-chromosoom. Vrouwen hebben twee geslachtschromosomen, namelijk twee X-chromosomen; mannen hebben als geslachtchromosoom een X- en een Y-chromosoom. Een dochter krijgt van de moeder en van de vader elk een X-chromosoom. Een zoon krijgt van de moeder haar X-chromosoom en van de vader het Y-chromosoom. In het geval van geslachtsgebonden hemolytische anemieën betreft het X-gebonden vormen, waarbij het aangetaste gen op het X-chromosoom zit. Jongetjes hebben slechts één X-gen dat noodzakerlijkerwijze van hun moeder komt, die draagster is en die het aangetaste gen doorgeeft aan de helft van haar kinderen, waarbij de zoons de ziekte krijgen terwijl de dochters, die een tweede, gezond X-gen van hun vader krijgen, draagster worden.
Fouten in de hemoglobineketens: thalassemie
Er zijn vier hemogloblineketens, twee alfaketens en twee bètaketens (dia 2). Op alle manieren kunnen hier fouten in staan, waardoor een of meer van deze vier niet goed werkt. Een rode bloedcel met te weinig normale hemogloblineketens werkt minder goed en wordt veel sneller afgebroken.
Deze ziekten worden gerekend tot de thalassemieën. De naam thalassemie stamt af van het Griekse ’thalassa’, wat ‘zee’ betekent, omdat deze groep erfelijke aandoeningen vooral in het gebied rond de Middellandse Zee voorkomt, en verder in Zuid-Oost Azië. De ziekte kan desalniettemin ook bij ‘gewone’ Nederlanders voorkomen. Afhankelijk van de uitgebreidheid van het aantal uitgevallen ketens zal de mate van bloedarmoede ernstiger zijn. Als slechts één keten is uitgevallen, zullen er geen of nauwelijks klachten zijn. Zo’n patiënt wordt als drager beschouwd en heeft een normale levensverwachting. Als deze met een andere partner-drager kinderen krijgt, is er 25 procent kans op het krijgen van een kind met uitval van meerdere ketens, wat wel met ernstige symptomen gepaard zal gaan. Patiënten met ernstige thalassemie hebben ernstige bloedarmoede en hebben hun hele leven bloedtransfusies nodig. Rode cellen bevatten veel ijzer. Daarom is ijzerstapeling uiteindelijk een van de ernstige complicaties van deze ziekte. Met al die transfusies krijgen patiënten ongewenst veel ijzer mee toegediend. Het teveel aan ijzer wordt onder meer opgeslagen in de lever, het hart, de alvleesklier, de bijnieren en de geslachtsorganen. Daardoor ontstaat een tekort aan hormoonproductie en uiteindelijk hart- en leverfalen. Zonder behandeling zal dit uiteindelijk tot de dood leiden. Daarnaast zullen de darmen van dit type patiënten door de ernstige bloedarmoede maximaal ijzer uit de voeding opnemen, een tweede mechanisme waardoor ijzerstapeling kan ontstaan. Het moge duidelijk zijn dat thalassemiepatiënten met hun ernstige bloedarmoede dus nooit extra ijzer moeten krijgen. Integendeel, ze moeten levenslang behandeld worden met ontijzerende therapie in de vorm van injecties of tabletten.
Er is geen specifieke behandeling van thalassemie mogelijk. De enige radicale therapie bestaat uit stamceltransplantatie, waarbij de complete bloedcelaanmaak wordt vervangen door die van een donor. Deze behandeling heeft veel bijwerkingen en risico’s en is voor lang niet iedereen mogelijk of zinvol.
Meer weten? Er is een patiëntenvereniging voor patiënten met thalassemie en sikkelcelanemie, genaamd Oscar. Zij hebben een uitgebreide website met erg veel informatie, met ook tekst in het Engels en in het Turks.
Oscar Nederland
Postbus 4
3980 CA Bunnik
www.oscarnederland.nl
Fouten in de hemoglobineketen: sikkelcelanemie
Sikkelcelanemie is een ziekte typisch gekoppeld aan het negroïde ras en ook het Aziatische ras (dia 6). Bij sikkelcelanemie gaat de rode bloedcel – door een fout in de hemogloblineketen – bij een verzuurde omgeving en bij een tekort aan zuurstof vervormen tot een scherpe halve maan, een sikkel. Wanneer deze sikkelvorming optreedt, gaan de rode bloedcellen klonteren waardoor de bloedvaten verstopt kunnen raken en de doorbloeding afneemt, een zogenaamde sikkelcelcrise. Dit gaat gepaard met een zo hevige pijn dat patiënten opgenomen moeten worden voor behandeling.
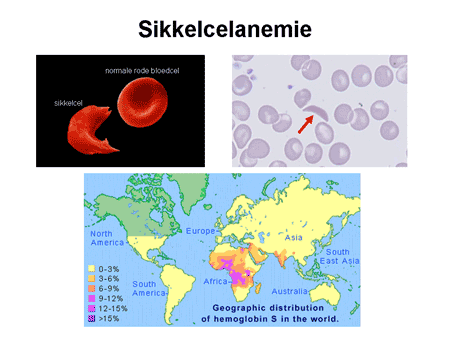
Dia 6
De defecte rode bloedcellen leven korter, waardoor er sprake is van chronisch bloedarmoede. Patiënten met sikkelcelanemie hebben vanaf het eerste levensjaar al een sterk verhoogde gevoeligheid voor infecties omdat hun milt niet goed meer werkt door de sikkelcelbeschadigingen. Er is vooral op de kinderleeftijd een groot risico op herseninfarcten, en gedurende het hele leven op beschadiging van longen, botten en nieren.
Er is geen specifieke behandeling voor sikkelcelanemie. Patiënten moeten levenslang beschermd worden tegen infecties, zoals ook gebeurt bij patiënten zonder functionerende milt (zie Infectiepreventie bij volwassenen zonder goed functionerende milt). Bij elke crise is intensieve pijnbestrijding en infectiebehandeling nodig. Wisseltransfusies kunnen zinvol zijn.
De enige radicale therapie bestaat uit stamceltransplantatie, waarbij de complete bloedcelaanmaak vervangen wordt door die van een donor. Deze behandeling heeft veel bijwerkingen en risico’s en is voor lang niet iedereen mogelijk.
Meer weten? Er is een patiëntenvereniging voor patiënten met thalassemie en sikkelcelanemie, genaamd Oscar. Zij hebben een uitgebreide website met erg veel informatie, met ook tekst in het Engels en in het Turks.
Oscar Nederland
Postbus 4
3980 CA Bunnik
www.oscarnederland.nl
Fouten in de enzymen: G6PD-deficiëntie
G6PD is een enzym in de rode bloedcel, belangrijk voor de energiehuishouding en het zuurstoftransport. G6PD-deficiëntie is een erfelijke aandoening die voornamelijk bij mannen voorkomt en wordt doorgegeven door de moeder. Wereldwijd komt de ziekte veel voor, de schatting is dat er meer dan 400 miljoen mensen met een G6PD-deficiëntie zijn. Patiënten met een tekort aan het enzym G6PD hebben meestal geen klachten, tenzij ze worden blootgesteld aan een situatie waarin de werking van het enzym belangrijk is om de rode cel te beschermen. Ontbreekt het enzym in die situatie, dan zal de rode bloedcel kapotgaan. Er ontstaat dan een plotselinge heftige afbraak van de rode bloedcellen. Dit komt vooral voor bij infecties en bij het gebruik van bepaalde geneesmiddelen en bij het eten van bepaalde voedingsmiddelen, waarvan tuinbonen het bekendste voorbeeld zijn. Tussendoor is er soms sprake van chronische hemolyse die meestal goed gecompenseerd kan worden, en zullen de meeste patiënten weinig of geen klachten hebben.
De diagnose kan gesteld worden door de hoeveelheid G6PD te meten in de rode bloedcellen. Belangrijk is dat dit gebeurt in een rustige fase en niet direct na een aanval van hemolyse. Bij hemolyse is er immers een toename van jonge rode cellen. De hoeveelheid G6PD neemt af naarmate een rode cel ouder wordt. Wordt de test uitgevoerd tijdens een fase van veel jonge cellen, dan valt deze dus vals normaal uit.
Patiënten met een G6PD-deficiëntie moeten goed op de hoogte zijn van wat zij wel en niet als medicijnen mogen gebruiken. Zie voor een beperkt overzicht de tabel onder ‘Deficiëntie glucose-6-fosfaatdehydrogenase (G-6-PD)’ in Hemolytische anemie.
Fouten in de enzymen: pyruvaatkinase (PK)-deficiëntie
Fouten in de erytrocytenmembraan: hereditaire sferocytose en andere beelden
Bij sferocytose zijn er fouten opgetreden in de buitenlaag van de rode bloedcel. Deze zal kleine stukjes verliezen en uiteindelijk van vorm veranderen richting een klein compact bolletje, dat door de milt verwijderd wordt. De naam komt van ‘sferocyt’, dat ‘bol’ betekent. De aandoening komt vaak voor; de schatting is dat 1 op de 2000 mensen de afwijking heeft, evenveel mannen als vrouwen. Hereditaire (erfelijke) sferocytose varieert sterk in de ernst van de bloedarmoede. Het kan zijn dat pas als bij een jong kind de diagnose gesteld wordt, bekend wordt dat de grootmoeder de ziekte ook heeft en aldus heeft doorgegeven. Zij had zo weinig symptomen dat een en ander nooit aan het licht is gekomen.
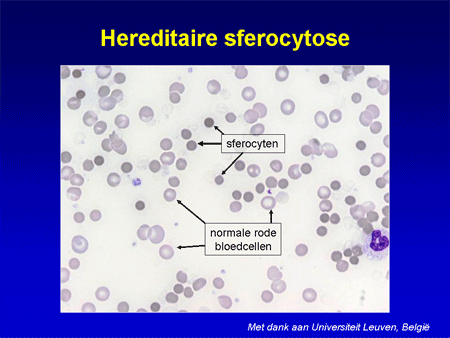
Dia 7
De diagnose kan gesteld worden door allereerst in een eenvoudig bloeduitstrijkje de vorm van de rode cellen te bekijken. Vervolgens kan met geavanceerde technieken het specifieke membraandefect aangetoond worden.
Behandeling is vaak niet nodig. Bij ernstige vormen wordt de milt verwijderd. Door de milt te verwijderen is het ziektebeeld als het ware genezen. De rode cellen zijn nog wel licht afwijkend, maar worden niet meer versneld uit de bloedbaan verwijderd en de bloedarmoede is geen probleem meer. Bij veel patiënten is de bloedarmoede echter niet ernstig genoeg dat het nodig is om de milt weg te halen.
Behalve hereditaire sferocytose zijn er ook andere varianten, die veel zeldzamer zijn. Een ervan is hereditaire elliptocytose, waarbij door een membraandefect de rode cellen de vorm van een ellips (sigaarvormig) aannemen. Nog zeldzamer is het ziektebeeld hereditaire pyropoikylocytose, waarbij vooral bij hoge koorts de rode cellen sterk van vorm veranderen en voor hemolyse vatbaar zijn.
Verworven hemolytische anemie: AIHA, mechanische en toxische oorzaken, PNH
Vormen van verworven hemolytische anemie zijn:
- Auto-immuun hemolytische anemie (AIHA)
- Hemolyse door mechanische en toxische oorzaken
- PNH: Paroxysmale Nachtelijke Hemogloblinurie
Auto-immuun hemolytische anemie (AIHA)
AIHA is een ziekte waarbij de rode bloedcellen (erytrocyten) worden afgebroken door antistoffen die door het lichaam zelf zijn aangemaakt. Deze antistoffen heten auto-antistoffen (auto = zelf). De ziekten waartoe AIHA gerekend wordt, heten auto-immuunziekten (immuun = afweer; auto-immuun = afweer tegen zichzelf). Bij auto-immuunziekten is de afweer abusievelijk tegen onderdelen van het lichaam zelf gericht.
Auto-immuun hemolytische anemie komt zowel bij kinderen als bij volwassenen voor. De tekst hieronder betreft vooral de volwassen patiënt.
Oorzaken van auto-immuun hemolytische anemie
Bij de meeste patiënten zal er sprake zijn van een plotseling ontstane bloedarmoede, soms na een infectie of gebruik van een medicament, maar ook vaak zonder duidelijke aanleiding. AIHA komt nogal eens voor samen met andere aandoeningen, vooral met andere auto-immuunziekten.
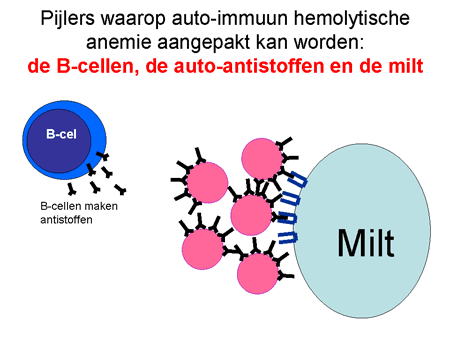
Bij de ziekte AIHA maakt het lichaam antistoffen gericht tegen eiwitten op het oppervlak van de rode bloedcellen. De cellen verantwoordelijk voor de auto-antistofproductie zijn de B-lymfocyten of B-cellen (dia 9, 10, 11, 12 en 13). De B-cellen zijn overal in het lichaam aanwezig, maar vooral in de lymfklieren, in het bloed en beenmerg, en in groten getale in de milt.

Dia 8

Dia 9
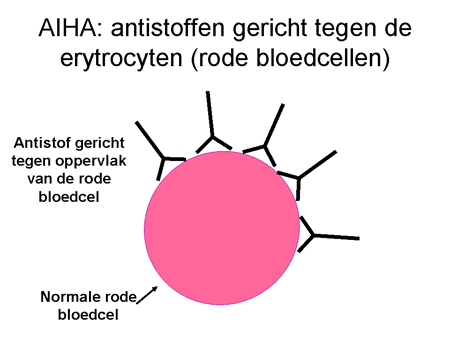
Dia 10
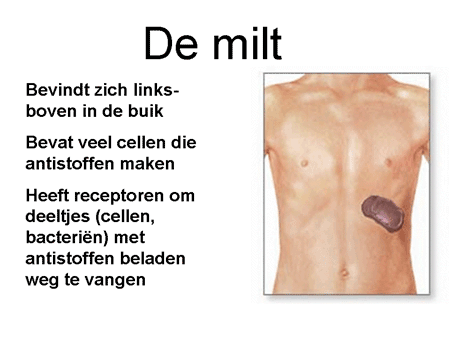
Dia 11
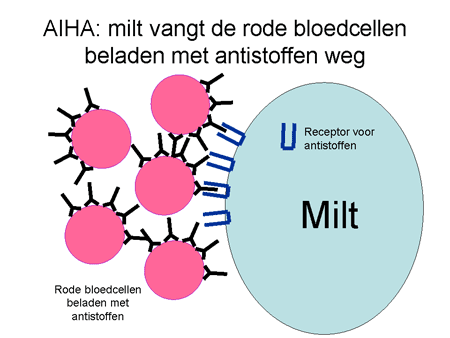
Dia 12
Dia 13
De antistoffen hechten zich aan de rode bloedcellen en blijven erop zitten. Met antistof en al worden deze cellen zeer snel (binnen enkele minuten) afgebroken. Die afbraak kan op twee manieren. Allereerst kunnen de cellen door de milt verwijderd worden. Een alternatief is dat ze door bepaalde eiwitten (het complementsysteem) in de bloedbaan zelf al uitgeschakeld worden. In dat geval kan het gebeuren dat een patiënt donkere urine loost vanwege de afgebroken rode cellen. De milt is een orgaan waar al het bloed doorheen gaat. Hij verwijdert elementen via cellen waarop een receptor zit die antistoffen (ongeacht wat daar dan weer aan vastzit) kan binden (zie dia 12). Het uiteindelijke resultaat is dat de rode bloedcel uit de bloedbaan verwijderd wordt met daardoor een sterke daling van de rode bloedcellen, en dus bloedarmoede. Het lichaam probeert als compensatie wel meer rode cellen aan te maken, maar meestal lukt dit onvoldoende.
Alle therapiemogelijkheden proberen dan ook op deze verschillende oorzaken in te spelen (zie Behandeling van auto-immuun hemolytische anemie).
Onderzoek gericht op auto-immuun hemolytische anemie
Om de diagnose auto-immuun hemolytische anemie te stellen is extra onderzoek nodig. Dit onderzoek is enerzijds erop gericht de diagnose te bevestigen en anderzijds om andere oorzaken van bloedarmoede redelijkerwijze uit te sluiten. Meestal is het goed mogelijk om in het bloed aan te tonen dat er antistoffen aanwezig zijn die al dan niet ook al op de eigen rode cellen zitten, met de zogenaamde Coombs-test.
Als er echter twijfel is over de diagnose, of als het een oudere patiënt betreft (ouder dan 50 tot 60 jaar), wordt er voor de zekerheid ook beenmergonderzoek verricht om uit te sluiten of er niet bijkomende ziekten (vooral van het systeem van de lymfocyten) in het spel zijn. Via bloedonderzoek moet worden vastgelegd hoe intensief de afbraak is en in hoeverre de overige bloedcellen helemaal normaal zijn. Er zal gezocht worden naar recent doorgemaakte infecties. Ook zal onderzoek gedaan worden naar andere auto-antistoffen, omdat het ziektebeeld soms samengaat met andere auto-immuunziekten. De erytrocyten worden weggevangen in de milt. Daarom wordt meestal ook een echo of scan van de milt gemaakt.
Koude- en warmte-antistoffen, IgG- en IgM-antistoffen
Het is belangrijk uit te zoeken welk type auto-antistoffen verantwoordelijk is voor de hemolyse. Sommige antistoffen – vooral van het IgM-type – hebben namelijk de bijzondere eigenschap dat ze direct in staat zijn de rode cel af te breken, terwijl andere antistoffen (IgG) de hulp van de milt nodig hebben. Daarnaast blijkt dat sommige antistoffen vooral actief worden bij lagere temperaturen en dan de rode cellen laten samenklonteren. Dit laatste heet ook wel het koude-agglutininesyndroom (agglutineren = samenklonteren). Patiënten met een koude-agglutininesyndroom hebben behalve hun bloedarmoede door de verhoogde afbraak ook symptomen in relatie tot het klontereffect. Het optreden van het klonteren is temperatuurbepaald: hoe lager de temperatuur waarbij het klonteren optreedt, hoe minder risico een patiënt loopt op ernstige verschijnselen. Wanneer de temperatuursgrens laag is, zullen patiënten alleen in de winter klontering en afbraak krijgen in hun vingers, in de neus, kortom, in de uitstekende lichaamsdelen die makkelijk afkoelen. Ligt de temperatuursgrens hoger en dichter bij de gewone lichaamstemperatuur, dan is het zaak de omgevingstemperatuur verder op te stoken en – in heel enkele gevallen – patiënten een verhuisadvies te geven en hun te adviseren de koude regionen te mijden. Als er een bloedtransfusie nodig is (of een ander infuus), moet de vloeistof altijd van tevoren verwarmd worden via een infuusverwarmer.
Behandeling van auto-immuun hemolytische anemie
De behandeling (dia 14, 15 en 16) is gericht op twee zaken:
- het opvangen van de bloedarmoede;
- het uitschakelen van de oorzaak.
Ad 1. Wat het behandelen van de bloedarmoede betreft: het is niet altijd makkelijk om bij een auto-immuun hemolytische anemie een geschikte donor voor een bloedtransfusie te vinden. De antistoffen in de patiënt zullen immers vaak ook reageren met de rode bloedcellen van de donor. Het duurt daarom vaak erg lang (vele uren testen op het laboratorium) om een geschikte donor te vinden. Dit betekent dan ook dat de arts wat meer terughoudend dan normaal zal zijn om een patiënt een transfusie aan te bieden, maar als het niet anders kan wegens klachten of wegens de risico’s die een patiënt zou kunnen lopen bij te ernstige bloedarmoede, dan wordt, heel voorzichtig, het best passende bloed gegeven met veel extra controles aan het bed.
Ad 2. Er zijn veel verschillende behandelingsmogelijkheden gericht op het uitschakelen van de ontregelde auto-antistofproductie. Gebruikelijk is om te beginnen met prednisontherapie (zie de tabel 1), tenzij er sprake is van het koude-agglutininesyndroom, omdat prednison dan niet helpt. Als de ziekte daar onvoldoende op reageert, of als die bij het minderen van de prednison weer activiteit vertoont, zijn er meerdere andere behandelmogelijkheden.

Dia 14

Dia 15

Dia 16
| Behandeling | Aangrijpingspunt | Bijzonderheden |
|---|---|---|
| Prednison |
|
Niet bij koude-agglutininesyndroom |
| Splenectomie (verwijderen van de milt) |
|
Niet bij koude-agglutininesyndroom |
| Gammaglobuline | Blokkeert voor enkele dagen de receptor in de milt | |
| Rituximab | Schakelt B-cellen uit | Vooral bij koude-agglutininesyndroom |
| Azathioprine (Imuran) Cyclofosfamide (Endoxan) |
Schakelen B-cellen uit | |
| Danazol | Stimuleert de aanmaak van rode bloedcellen | |
| Plasmaferese | Verwijdert de antistoffen uit de bloedbaan | Vooral bij IgM-antistoffen en bij koude-agglutininesyndroom |
We gaan hier wat dieper in op een aantal van de therapiemogelijkheden:
Prednison
Bij de acute vorm wordt altijd geprobeerd de auto-immuunreactie te blokkeren, de ziekte uit te doven en daarmee de auto-immuun hemolytische anemie te genezen. De standaardtherapie hierbij is prednison (of het haast identieke prednisolon). Prednison werkt op twee manieren: het remt de aanmaak van de antistoffen door de B-cellen en blokkeert ook de werking van de milt betreffende het wegvangen van de erytrocyten met antistoffen. Met een kuur prednison lukt het bij de grote meerderheid van de patiënten om het ziektebeeld rustig te krijgen.
Prednison heeft helaas bijwerkingen: het geeft veel energie waar men onrustig van kan worden en slecht door kan gaan slapen, het verhoogt de eetlust waardoor het moeilijk kan zijn om niet in gewicht aan te komen, en het gezicht wordt dikker (vollemaansgezicht), maar al deze bijwerkingen zijn van tijdelijke aard. Na het stoppen van de prednison wordt alles weer normaal, inclusief het uiterlijk.
Prednison wordt in principe meerdere weken in een hoge dosis gegeven en bij succes, langzaam afgebouwd in de loop van een paar maanden. Te snel afbouwen maakt de kans groter dat de hemolytische anemie weer opvlamt.
Splenectomie
Als de hemolytische anemie onvoldoende reageert of bij minderen van de prednisondosis weer terugkomt, komt de tweedelijns behandeling in beeld. Deze bestaat bij de meest voorkomende vorm van AIHA uit splenectomie, het verwijderen van de milt.
Na splenectomie is wederom een groot deel van de patiënten vrij van ziekte, of heeft in ieder geval een veel hoger gehalte aan rode bloedcellen dan voor de operatie. Een splenectomie is een radicale ingreep, maar is met de moderne operatietechnieken via een kijkoperatie erg veilig. Bovendien kan een mens heel goed zonder milt leven, ook al zijn er een aantal belangrijke voorzorgsmaatregelen nodig (zie Infectiepreventie bij volwassenen zonder goed functionerende milt).
Rituximab
Overige therapiemogelijkheden
Meer weten?
De patiëntenvereniging Stichting Zeldzame Bloedziekten moedigt patiënten met een AIHA aan zich te melden.
E-mail: info@bloedziekten.nl
Website: www.bloedziekten.nl
Hemolyse door mechanische en toxische oorzaken
Behalve door de reeds genoemde oorzaken, kunnen rode bloedcellen ook kapotgaan door puur fysische oorzaken.
Mechanische oorzaken
De rode bloedcellen worden beschadigd door onder andere kunstkleppen in het hart: bij elke hartslag worden als het ware enkele rode bloedcellen geplet tussen de bladen van de kunstklep. Berucht, alhoewel eerder zeldzaam, is ook de ‘marshemoglobinurie’. Bij zware inspanningen zoals marathonlopers die verrichten, worden de rode cellen in de voetzolen bij elke stap platgedrukt tegen de bodem. Beide voorbeelden van hemolyse gaan gepaard met het in de bloedbaan zelf beschadigen van de rode bloedcellen met als gevolg verlies van ijzer via de nieren. Deze patiënten hebben dan ook baat bij ijzertherapie (afgezien van het zonodig verhelpen van de oorzaak).
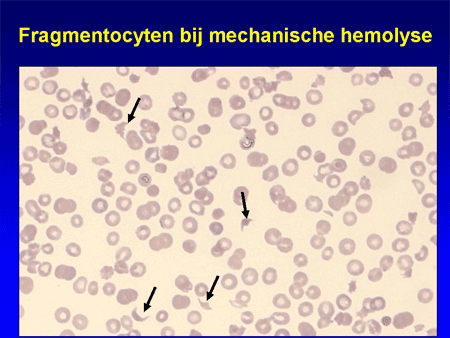
Soms worden de bloedcellen gekliefd in de bloedbaan als ze met hoge snelheid door bloedvaten razen waarin zich stolsels ontwikkelen. De fibrinedraden die het stolsel gaan vormen, snijden stukjes uit de bloedcel; onder de microscoop worden deze herkend als ‘fragmentocyten’ en de vorm van anemie die er het gevolg van is, wordt ‘micro-angiopathische anemie’ genoemd.
Infectie
Sommige specifieke infecties kunnen direct leiden tot anemie door bloedafbraak. Deze zijn dus te onderscheiden van meer algemene effecten van een infectie, zoals het onderdrukken van aanmaak in het beenmerg (meest uitgesproken door het eerdergenoemde Parvo B19-virus) of een micro-angiopathisch mechanisme bij zeer ernstige infecties. Te vermelden zijn vooral malaria, dat de rode bloedcellen parasiteert, en Clostridia-bacteriën, die voor rode bloedcellen toxische stoffen produceren.
PNH: Paroxysmale Nachtelijke Hemogloblinurie
PNH is een zeer zeldzame aandoening waarbij rode bloedcellen aanvalsgewijs in de bloedbaan afgebroken worden. De donkere kleurstof van de kapotte rode bloedcel wordt via de urine uitgescheiden. Omdat dit nogal eens ’s nachts gebeurt, heeft de ziekte deze bijzondere naam gekregen (paroxismaal = aanvalsgewijs).

Dia 18
Per jaar wordt bij een tot twee nieuwe patiënten per miljoen inwoners de diagnose gesteld. De schatting is dat er in Nederland circa 250 patiënten met een PNH zijn.
Oorzaak en symptomen van PNH
Rode bloedcellen zijn een soort voorraadkamers voor het eiwit hemoglobine dat zuurstof transporteert. Door middel van een buitenmembraan wordt de binnenkant van de rode bloedcel beschermd. Deze bescherming vindt plaats dankzij een complex van eiwitten op het oppervlak van de membraan. Deze eiwitten zorgen ervoor dat de rode bloedcel in een te zure of zoete omgeving toch intact blijft en niet uit elkaar knapt.
Bij de ziekte PNH ontstaat in de loop van het leven een fout in enkele eiwitten op het oppervlak van rode cellen, en overigens ook van andere bloedcellen. De fout begint in een van de bloedvormende stamcellen en wordt vervolgens in alle nakomelingen van die ene stamcel aangetroffen. Door de fout zal een groep van eiwitten niet meer goed op het oppervlak van de cel geplaatst kunnen worden.
PNH is dus geen erfelijke ziekte, maar een verworven aandoening. Karakteristiek kunnen in een patiënt vaak normale en PNH-bloedcellen naast elkaar aangetroffen worden. Waarom de fout ontstaat is niet bekend. PNH-cellen komen niet alleen voor bij de ziekte PNH, maar het fenomeen van deze fout blijkt ook in andere situaties te kunnen optreden. PNH-cellen worden namelijk ook weleens aangetroffen bij andere ziekten zoals aplastische anemie of myelodysplastisch syndroom.
Door de fout zijn rode bloedcellen minder goed bestand tegen geringe zuurvorming van het bloed en zullen ze kapotgaan. Dit kan gebeuren bij ernstige infecties, maar ook vaak gedurende de nachtrust. ’s Nachts is bloed op plaatsen in het lichaam waar het langzamer stroomt licht zuur, en op die plaatsen zal daarom bij PNH-patiënten bloedcelafbraak plaatsvinden. De inhoud van de afgebroken rode cellen wordt via de nieren in de urine uitgescheiden en de patiënt zal de volgende ochtend donkere urine lozen. Een voor de hand liggende vraag is natuurlijk waarom niet alle bloedcellen dan kapotgaan. Dit heeft te maken met het feit dat de witte bloedcellen en bloedplaatjes extra verdedigingsmechanismen hebben die de rode bloedcellen missen.
Dit verklaart dan ook de symptomen van een PNH-patiënt: bloedarmoede met tekenen van verhoogde celafbraak bij laboratoriumonderzoek en vaak aanvalsgewijs donkere urine (dia 17).
PNH-patiënten blijken ook een verhoogd risico te hebben op trombose, omdat door dezelfde fout in het membraansysteem bepaalde corrigerende stollingseiwitten niet goed werken, waardoor de stolling sneller en ongecontroleerd verloopt. Tromboses kunnen verantwoordelijk zijn voor ernstige, zelfs levensbedreigende complicaties, die maken dat PNH niet kan beschouwd worden als een onschuldige ziekte.
Hoe wordt de diagnose PNH gesteld?
De combinatie van bloedarmoede, tekenen van verhoogde celafbraak en donkere urine (zie dia 17) is sterk suggestief voor het ziektebeeld PNH. De definitieve diagnose kan op twee manieren gesteld worden. De ouderwetse test bestond uit het blootstellen van rode bloedcellen in zuur milieu. PNH-cellen zullen sneller kapotgaan dan normale cellen. Deze test is echter niet feilloos. Tegenwoordig wordt daarom met flowcytometrie op bloedcellen de afwezigheid van de specifieke membraanmarker waarin de fout is opgetreden aangetoond. Omdat PNH samen kan gaan met andere ziekten (zie hierboven), zal daar ook onderzoek naar gedaan worden in de vorm van beenmergonderzoek en chromosomenonderzoek (cytogenetisch onderzoek).
Dia 17
Therapie van PNH
Ondersteunende maatregelen zijn het belangrijkst. Afhankelijk van de ernst van de bloedarmoede moeten zo nodig bloedtransfusies gegeven worden. Afhankelijk van eventuele reacties op een bloedtransfusie moeten de bloedcellen zo nodig extra gewassen worden. Vroeger gebeurde dit vaak, maar het blijkt lang niet altijd nodig te zijn.
Als tweede maatregel is het belangrijk om beschermende medicijnen tegen trombose te gebruiken, aangezien PNH-patiënten een verhoogd risico hierop hebben.
Wanneer de hemolyse te ernstig is en er te vaak bloedtransfusies nodig zijn, heeft het zin een behandeling met een lage dosis prednison te geven. Ook is behandeling met hormonen zoals Danazol soms zinvol.
Een nieuwe therapie, die echter nog lang niet overal beschikbaar is, bestaat uit een infuus met een antistof (eculizimab) waarmee de verhoogde afbraak van rode bloedcellen sterk geremd wordt. Deze behandeling zal niet genezend zijn, maar alleen werkzaam zolang de infusen gegeven worden.
Beloop en prognose
Het beloop is zeer variabel. Bij enkele patiënten is waargenomen dat het aantal PNH-cellen afneemt en daarmee de ziekte zelfs verdwijnt. Bij de meerderheid zal dit niet het geval zijn. Er is in de loop van de jaren een kans op verdere achteruitgang van het beenmerg richting het ziektebeeld aplastische anemie. Tot slot is er bij een klein percentage van de patiënten (minder dan 5 procent) kans op de ontwikkeling richting acute myeloïde leukemie. Het risico op tromboses, bijvoorbeeld in de bloedvaten van de buik, is ook steeds aanwezig, vooral bij infecties, operaties of immobilisaties, en kan mede oorzaak zijn van verkorte overlevingskansen.
Meer weten? Er is geen aparte patiëntenvereniging voor PNH, maar de patiëntenvereniging Stichting Zeldzame Bloedziekten heeft voor PNH-patiënten ruimte en informatie op haar website.
E-mail: info@bloedziekten.nl
Website: www.bloedziekten.nl